ቪዲዮ: ቀመር m1v1 m2v2 ምንድን ነው?

2024 ደራሲ ደራሲ: Miles Stephen | [email protected]. ለመጨረሻ ጊዜ የተሻሻለው: 2023-12-15 23:33
የተከማቸ ወይም የተሟሟት መፍትሄን በመጠቀም ትኩረትን ወይም መጠንን መፍታት ይችላሉ። እኩልታ : M1V1 = M2V2 , ኤም 1 በ molarity (ሞልስ / ሊትር) ውስጥ ያለው የተከማቸ መፍትሄ, V2 የተከማቸ መፍትሄ መጠን ነው, M2 በ dilute መፍትሄ ውስጥ ያለው ትኩረት (በኋላ)
በተመሳሳይም m1v1 m2v2 ለምን ይሰራል?
የሚለዋወጠው እና መጠኑ የሚለወጠው ትኩረቱ ብቻ ነው. ተጨማሪ ሶሉቱን ካላከሉ በስተቀር የሶሉቱ ሞሎች ብዛት ቋሚ ነው! ስለዚህ ግንኙነቱ የተመሰረተው የሶሉቱ ሞለዶች ቁጥር በቋሚነት እንደሚቀጥል ነው, ነገር ግን የመፍትሄው ትኩረት እና መጠን ሊለወጥ ይችላል.
በመቀጠል፣ ጥያቄው n1v1 n2v2 ቀመርን እንዴት ይጠቀማሉ? N1V1 (HCl) = N2V2 (Na2CO3) ወይም N1× 10 = 0.2 × 25 ∴ N1 = 5/10 = 0.5 N Normality × Equivalent weight = ጥንካሬ በአንድ ሊትር። 0.5 × 36.5 = 18.25. የ HCl መፍትሄ ጥንካሬ በአንድ ሊትር 18.25 ግራም ነው.
በተጨማሪም ፣ የቲትሬሽን ቀመር ምንድነው?
የሚለውን ተጠቀም titration ቀመር . ቲትራንት እና አናላይት 1፡1 ሞል ሬሾ ካላቸው፣ እ.ኤ.አ ቀመር የአሲድ x መጠን (V) የአሲድ = ሞለሪቲ (ኤም) የመሠረቱ x መጠን (V) መሠረት ሞላሪቲ (ኤም) ነው። (Molarity በአንድ ሊትር መፍትሄ እንደ የሶሉቱ ሞሎች ብዛት የሚገለጽ የመፍትሄው ትኩረት ነው።)
m1v1 m2v2 እንዴት ይጠቀማሉ?
ለተሰበሰበው ወይም ለተቀባው መፍትሄ ትኩረት ወይም መጠን መፍታት ይችላሉ። በመጠቀም እኩልታው፡- M1V1 = M2V2 , M1 በ molarity (ሞልስ / ሊትር) የተከማቸ መፍትሄ, V2 የተከማቸ የመፍትሄው መጠን ነው, M2 በ dilute መፍትሄ ውስጥ ያለው ትኩረት (በኋላ)
የሚመከር:
የ octane ተጨባጭ ቀመር ምንድን ነው?

C8H18 እዚህ፣ የ octane c8h18 ተጨባጭ ቀመር ምንድን ነው? የ የ octane ተጨባጭ ቀመር $$C_{8}H_{18}$$ ነው፡ A. ለ. ሲ. በተመሳሳይ የ c2h6o2 ተጨባጭ ቀመር ምንድን ነው? ሞለኪውላዊ እና ተጨባጭ ቀመሮች ጥያቄ መልስ ለሚከተለው ውህድ ተጨባጭ ቀመር ይጻፉ፡ C6H8 C3H4 ለሚከተለው ውህድ ተጨባጭ ቀመር ይፃፉ፡ X39Y13 X3Y የግቢው WO2 ተጨባጭ ቀመር ምንድን ነው?
የሲን ኮስ ታን ቀመር ምንድን ነው?
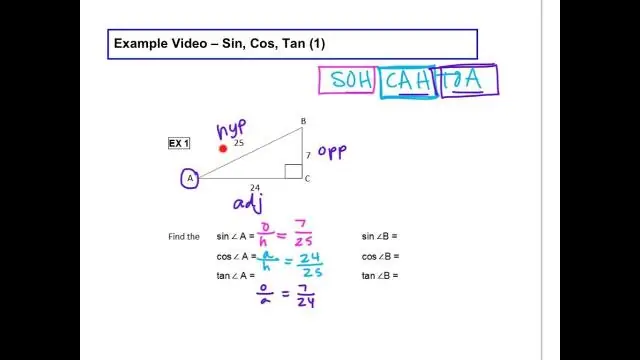
የኃጢያት፣ የኮስ እና የታንካን ተግባራት እንደሚከተለው ይሰላሉ፡- ሳይን ተግባር፡ sin(θ) = ተቃራኒ / ሃይፖቴንስ። CosineFunction: cos (θ) = አጎራባች / Hypotenuse.Tangent ተግባር: tan (θ) = ተቃራኒ / ከጎን
የትራንስፎርሜሽን ቅልጥፍና ቀመር ምንድን ነው?
በትራንስፎርሜሽን ሂደት ውስጥ ጥቅም ላይ በሚውለው የዲ ኤን ኤ መጠን የተሳካ ትራንስፎርመሮችን ቁጥር በመከፋፈል ሊሰላ ይችላል።
የፕሮጀክት እንቅስቃሴ ቀመር ምንድን ነው?

የፕሮጀክት ሞሽን ቀመሮች። ፐሮጀይል የመነሻ ፍጥነት የሚሰጠው ነገር ነው፣ እና በስበት ኃይል የሚሰራ። ፍጥነት ቬክተር ነው (መጠን እና አቅጣጫ አለው) ስለዚህ የአንድ ነገር አጠቃላይ ፍጥነት በ x እና y ክፍሎች ቬክተር ሲጨመር ሊገኝ ይችላል፡ v2 = vx2 + vy2
መዋቅራዊ ፎርሙላ ምንድን ነው በመዋቅራዊ ቀመር እና በሞለኪውል ሞዴል መካከል ያለው ልዩነት ምንድን ነው?

ሞለኪውላዊ ቀመር በአንድ ሞለኪውል ወይም ውህድ ውስጥ ያሉትን የተለያዩ አተሞች ትክክለኛ ቁጥሮች ለማመልከት ኬሚካላዊ ምልክቶችን እና ንኡስ ጽሑፎችን ይጠቀማል። ተጨባጭ ፎርሙላ በአንድ ውህድ ውስጥ ያሉትን አተሞች በጣም ቀላሉን፣ ሙሉ-ቁጥር ሬሾን ይሰጣል። መዋቅራዊ ፎርሙላ በሞለኪውል ውስጥ የሚገኙትን አቶሞች የማገናኘት ዝግጅትን ያሳያል
